
Menu
- (61) 98434-7948
- (61) 3327-1073
- [email protected]
RECOMENDAÇÕES ÀS UTI NEONATAIS NEUROLÓGICAS
SOCIEDADE DE PEDIATRIA DO DISTRITO FEDERAL
Departamento de Neonatologia
Dr. Carlos Alberto Moreno Zaconeta
Unidade de Neonatologia – HMIB
Brasília 03 de setembro 2019
Introdução ao Problema
A neonatologia é uma das especialidades médicas que mais evoluíram nas últimas décadas. O incremento do surfactante, óxido nítrico, ventilação protetora promoveram verdadeira revolução na redução da mortalidade neonatal. Entretanto, por diversas vezes esse incremento da sobrevida não se aacompanhou de um neurodesenvolvimento adequado.
Múltiplas patologias no período neonatal associam-se a alto risco de desenvolvimento de sequelas. O primeiro grupo de risco em destaque é a asfixia perinatal, doença com incidência de 1 a 8 por 1.000 nascidos vivos a termo (1) e que representa a terceira causa mais comum de morte neonatal (23%), após nascimento prematuro (28%) e infecções graves (26%) (2-4). Apesar dos importantes avanços citados nos cuidados perinatais nas últimas décadas, a asfixia continua a ser uma condição grave e leva a condição denominada encefalopatia hipóxico-isquêmica.
Os recém-nascidos com encefalopatia grave têm elevado risco de morte, paralisia cerebral e retardo mental entre os sobreviventes. Os recém-nascidos com encefalopatia moderada apresentam déficits motores significativos, deficiência motora fina, comprometimento da memória, disfunção visual, aumento da hiperatividade e atraso na prontidão escolar (5-8) .
Outra patologia que merece fundamental destaque é a prematuridade, com importante destaque no risco de sobrevivência acompanhada de déficits neurológicos. Estudos epidemiológicos apontam que no mundo nascem 1,15 milhões de asfixiados e 13 milhões de prematuros ao ano. Destes bebês, 233.000 asfixiados e 350.000 prematuros evoluirão com sequelas neurológicas moderadas/graves (1,9). Outro destaque importante é a população com cardiopatia congênita, patologia de alta prevalência, onde a injúria cerebral pode ocorrer por hipóxia ou hipofluxo cerebral, podendo ocorrer no período pré, intra ou pós-operatório, sendo a ocorrência de déficits neurológicos muito comuns nesta população (10).
Outras patologias também envolvem riscos importante de lesão neurológica permanente, destacando-se as principais condições de risco na tabela 1.
| 1. Pacientes com asfixia perinatal / encefalopatia hipóxico-isquêmica (EHI)/td> |
| 2. Prematuridade Extrema (em especial quando associado a hemorragia periventricular grave) |
| 3. Cardiopatia congênita |
| 4. Malformações cerebrais (ex: microcefalia, hidrocefalia) |
| 5. Infecções congênitas |
| 6. Sepse tardia / Meningite grave |
| 7. Erros inatos do metabolismo |
| 8. Período pós parada-cardiorrespiratória prolongada |
| 9. Crises convulsivas por causas diversas |
| 10. . Instabillidade Hemodinâmica / Ventilatória graves |
Trata-se de uma parcela da população que, quando afetada, demandará de cuidados específicos por toda a vida, representando um impacto social e econômico devastador. Estudos americanos (11) revelam custos durante a vida de crianças com deficiência incapacitante na ordem de U$ 67 bilhões. No Brasil o problema atinge proporções semelhantes e pode ser exemplificado pelo BPC – Benefício da Prestação Continuada, cujo custo em crescimento ascendente com auxílio a pessoas com deficiência incapacitante (2.3 milhoes de pessoas), custou aos cofres públicos em 2015 cerca de R$ 22 bilhões, dos quais R$4.6 bilhões destinados a crianças e adolescentes (mais de 500.000 acometidos), sendo as afecções neonatais a principal causa de deficiência adquirada nesta faixa etária. (12)
O racional para explicar as diferenças nestes custos pode ser exemplificado pela tabela abaixo, onde destaca-se a necessidade de um acompanhamento multidisciplinar, aumento expressivo no número de internações, cirurgias e necessidade de medicações especiais. Um painel brasileiro de especialistas estimou que ao longo de seus 20 primeiros anos de vida, crianças com deficiência incapacitante grave podem custar até 3 milhoes de reais, cerca de 150 vezes mais, do que crianças sem deficiências.
| Criança sem deficiência | Criança com deficiência leve | Criança com deficiência moderada | Criança com Deficiência Grave |
|---|---|---|---|
| Assistência em Saúde | Assistência em Saúde | Assistência em Saúde | Assistência em Saúde |
| Pediatria (Puericultura) | Pediatria + algumas especialidades ex: Neurologia | Pediatria + algumas especialidades ex: Neurologia Ortopedia Fisioterapia | Pediatria + Acompanhamento Multidisciplinar Extenso Neurologia Ortopedia Oftalmologia Otorrinolaringologia Cirurgia Infantil Neurocirurgia Fonoaudiologia Dentista Terapia Ocupacional Fisioterapia |
| Raras internações hospitalares | Internações infrequentes | Internações frequentes | Internações muito frequentes |
| Rara necessidade de cirurgias | Rara necessidade de cirurgias | Necessidade de Diversas Cirurgias | Frequente necessidade de múltiplas cirurgias |
| Não usa medicação contínua | Algumas fazem uso de medicação contínua | Frequente uso de algumas medicações de uso continuo | Uso de medicações múltiplas de uso continuo |
| Assistência Social: | Assistência Social: | Assistência Social: | Assistência Social: |
| Escola Normal | Escola Normal | Algumas necessitam de escolas especiais | Escolas Especiais |
| Crescer e produzir economicamente | Capacidade de estudar, crescer e produzir economicamente | Capacidade de produzir economicamente, porém de forma muito restrita | Incapacidade total Frequentemente vítimas de violência |
| Necessitam auxílios sociais | |||
| Não irão conseguir produzir economicamente |
Considerando este cenário, múltiplos centros norte-americanos e alguns centros brasileiros estão introduzindo o modelo de UTI Neonatal Neurológica, um ambiente altamente especializado, capaz de prover as mais avançadas metodologias para prevenção de sequelas neurológicas na população de risco. Dentre as metodologias citadas destacam-se a Hipotermia Terapêutica (tratamento específico para pacientes com asfixia) e o Monitoramento Cerebral Contínuo (aplicável para todos os recém-nascidos de alto risco).
No grupo dos pacientes com asfixia perinatal diversos estudos foram realizados para avaliação de terapias neuroprotetoras. Destacam-se seis grandes ensaios clínicos randomizados com uso de tratamento denominado Hipotermia Terapêutica (HT). Esses ensaios demonstraram que o resfriamento diminui a morte ou deficiências incapacitantes em lactentes aos 18-24 meses de idade (13-18). Metanálises recentes demonstraram que a hipotermia é eficaz e segura (19, 20). Experiências bem sucedidas na implantação de hipotermia terapêutica também já foram descritas em centros brasileiros.(21)
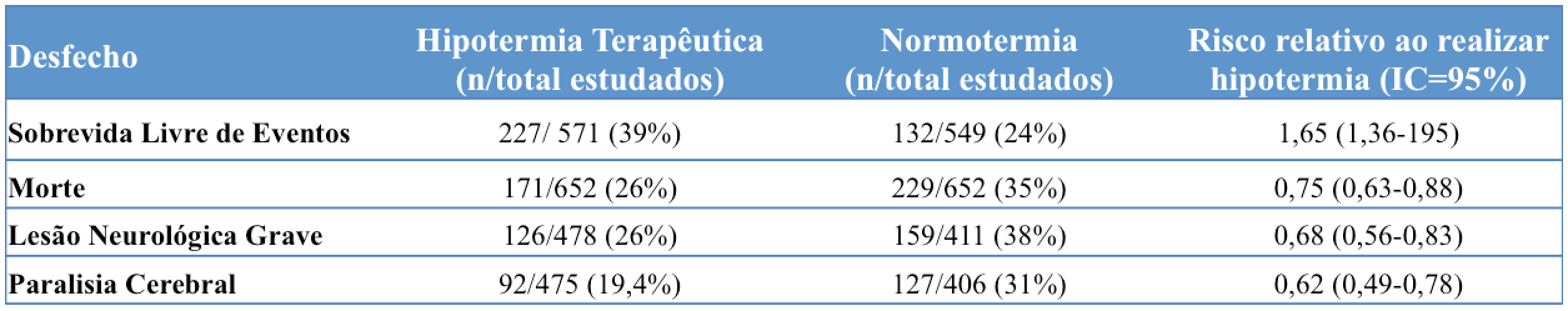
Ao avaliar o risco relativo na realização do tratamento com hipotermia terapêutica, os dados dessa meta-análise nos permitiram inferir que seu uso nesta população foi capaz de:
– Reduzir a mortalidade em 25% (Risco relativo – RR=0,75)
– Aumentar em 65% a chance de sobrevida normal (RR=1,65)
– Entre os sobreviventes:
• Reduzir em 32% a chance de dano neurológico grave (RR=0,68)
• Reduzir em 38% a chance de apresentar paralisia cerebral (RR=0,62)
Associadas ao uso da hipotermia terapêutica outras metodologias se fazem necessárias para abordagem da lesão cerebral em bebês com EHI. A asfixia perinatal representa a principal causa de crises convulsivas no período neonatal, representando de 40 a 60% da etiologia de convulsões em bebês a termo (22-24(1,95). Estudos revelam que mais de 80% das crises epilépticas (26, 27) e até mesmo estados de mal epiléptico dentro da UTI neonatal são completamente subclínicos. Portanto, faz parte do manejo do paciente com asfixia a aplicação de metodologias que permitem a avaliação precisa da atividade elétrica de base cerebral e o reconhecimento de crises convulsivas. Para isso o uso de eletroencefalografia contínua na UTI, que pode ser associada ao eletroencefalograma de amplitude integrada (aEEG) mostrou-se metodologia segura e eficaz.
Estudos clínicos demonstram grande aplicabilidade clínica, permitindo avaliação prognóstica e neurológica de recém-nascidos com asfixia perinatal (28, 29), e identificação de crises convulsivas (29). Alterações visualizadas de forma dinâmica na atividade de base e atividade epiléptica estão relacionadas a função e injúria cerebral, podem ser interpretadas em tempo real e permitem ações muito mais rápidas e assertivas em relação ao quadro clínico vigente.
Estudos revelam que o uso do aEEG/EEG aumentou a acurácia do tratamento de crises convulsivas (30, 31) sendo capaz de detectar 100% dos casos de mal epiléptico subclínicos e também a grande maioria das crises epiléticas repetitivas (30, 32).
Em recém-nascidos a presença de crises epilépticas é fator isolado de risco para atrasos no neurodesenvolvimento (33-36) e o reconhecimento e tratamento imediato reduz a sua duração e tem relação com melhor neurodesenvolvimento (37).
Além do benefício terapêutico, é evidenciado um grande benefício econômico ao se prevenir que uma criança evolua com sequelas neurológicas. Estudos clínicos evidenciam custo-efetividade ao promover a aplicação de metodologias comprovadamente eficazes para redução de sequelas neurológicas em recém-nascidos de alto risco (39).
O Brasil conta cerca de 3 milhões de nascidos vivos por ano e um alto número estimado de bebês com alto risco para injúria cerebral, incluindo recém-nascidos com EHI, prematuros, nascidos com cardiopatia congênita, malformações cerebrais, sepse grave entre outras condições de risco (42). Como qualquer país em desenvolvimento, os recursos disponíveis para cuidados neonatais são altamente variáveis. Algumas unidades terciárias neonatais localizadas nas principais cidades estão bem estruturadas e equipadas, enquanto grandes áreas do país não o são. Portanto, a implementação de hipotermia terapêutica e monitoramento cerebral contínuo pode não ocorrer ou acontecer de forma sub-ótima devido a vários fatores, incluindo falta de especialização, pessoal treinado, recursos, equipamentos, apoio contínuo de algumas subespecialidades (neurologia, cardiologia) e a estrutura geral necessária para cuidar desses bebês críticos.
Apesar do benefício descrito, estima-se que menos de 5% dos centros neonatais brasileiros utilizam hipotermia terapêutica ou monitoramento cerebral contínuo com eletroencefalograma para o atendimento de recém-nascidos de alto risco.
Após o I Simpósio Internacional de Neonatologia realizado em outubro de 2018 pela SPDF e SES-DF, o Hospital Materno Infantil de Brasilia (HMIB) realizou um projeto piloto, mediante uma parceria publico privada com a única empresa prestadora no país de serviços de telemedicina avançada para Implantação de UTI Neonatal Neurológica. No período de oito meses, o centro contou com treinamento inicial e longitudinal, implantação de protocolos validados internacionalmente, monitoramento cerebral contínuo remoto, assistência especializada 24 horas por dia e discussão de casos clínicos. Paralelamente, dois hospitais privados do DF implantaram o modelo de UTI Neonatal Neurológica seguindo idênticos principios.
O departamento de neonatologia da SPDF analizou os dados de monitoramento cerebral e UTI Neonatal Neurológica dos serviços público e privados e os resultados foram amplamente concordantes com a literatura internacional, sinalizando o benefício do monitoramento remoto e da UTI neurológica.
Foram monitorizados recém-nascidos com diagnósticos de suspeita de crise epiléptica, crises convulsivas prévias, asfixia perinatal com ou sem o uso de hipotermia terapêutica, cianose a esclarecer, sepse, malformação do SNC entre outros. Em um dos centros por exemplo, 20% dos recém-nascidos monitorados apresentaram crises epilépticas subclinicas e só puderam ser diagnosticadas graças ao emprego de UTI Neonatal Neurológica e monitorização cerebral via remota.
Levando em consideração que a parceria entre o HMIB e a citada empresa era por tempo limitado e que desde maio do ano em curso os neonatos da rede publica do DF não tem mais acesso ao monitoramento cerebral remoto e ao conceito de UTI Neonatal Neurológica, a SPDF ciente da responsabilidade que lhe cabe perante os recém-nascidos , suas famílias e os neonatologistas, recomenda:
– Implementação do conceito de UTI Neonatal Neurológica nos serviços de Neonatologia públicos e particulares, incluindo monitoramento remoto por aEEG .
– Hipotermia terapêutica para recém-nascidos ≥ 34 semanas com encefalopatia hipóxico-isquémica moderada ou grave (com ou sem convulsões) com até seis horas de vida, podendo se estender para doze horas em neonatos transportados. É preferível o uso de dispositivos específicos de resfriamento tipo colchão térmico.
– médicos, enfermeiros, fisioterapeutas e técnicos devem receber treinamento no conceito de UTI Neonatal Neurológica.
Referencias